渤健新研發(fā)的阿爾茨海默癥藥物被送至FDA
持續(xù)攀升的發(fā)病率,無(wú)藥可醫(yī)的困境,讓阿爾茨海默癥(AD)成了一道難以跨越的天塹,但凡有一絲研發(fā)喜訊,都會(huì)成為患者和家屬的寶貴希望。最新的好消息來(lái)自美國(guó)食品和藥物管理局(FDA),醫(yī)藥公司渤健和衛(wèi)材推出的阿爾茨海默癥藥物將會(huì)被送至FDA的評(píng)審臺(tái),時(shí)隔17年之后,F(xiàn)DA會(huì)再次批準(zhǔn)治療阿爾茨海默癥的新藥嗎?

新的希望
353美元,當(dāng)?shù)貢r(shí)間11月4日美股收盤(pán)時(shí),渤健的股價(jià)攀升了42%,幾乎是近期日均交易量的8倍,盤(pán)中一度漲至363.92美元,創(chuàng)下8個(gè)月以來(lái)的新高。
股價(jià)創(chuàng)新高的背后,是渤健在AD領(lǐng)域傳出來(lái)的喜訊。當(dāng)天,F(xiàn)DA在官網(wǎng)上公布了咨詢(xún)委員會(huì)提供的背景資料。
其中,F(xiàn)DA審評(píng)員指出,渤健的實(shí)驗(yàn)性AD藥物被證明有效,增加了其迅速獲得批準(zhǔn)的機(jī)會(huì)。“申請(qǐng)人已經(jīng)提供了大量的有效性證據(jù)來(lái)支持批準(zhǔn)”,F(xiàn)DA工作人員在該機(jī)構(gòu)網(wǎng)站上發(fā)布的一份審查該藥物的文件中表示。
根據(jù)安排,當(dāng)?shù)貢r(shí)間11月6日,由FDA召集的一個(gè)由外部專(zhuān)家組成的小組預(yù)計(jì)將會(huì)開(kāi)會(huì),討論渤健和衛(wèi)材公司用于治療AD患者的阿杜卡奴抗體(Aducanumab)生物制品許可(BLA)申請(qǐng),并投票決定是否向FDA推薦批準(zhǔn)這款創(chuàng)新療法。
據(jù)了解,阿杜卡奴抗體是一種與β淀粉樣蛋白(β-amyloid)結(jié)合的人類(lèi)單克隆抗體。它能夠有選擇性地與AD患者大腦中的淀粉樣蛋白沉積結(jié)合,然后通過(guò)激活免疫系統(tǒng),將沉積蛋白清理出大腦。主要是針對(duì)AD輕度認(rèn)知障礙患者。
早在今年7月,渤健和合作伙伴衛(wèi)材就向FDA提交了阿杜卡奴抗體的生物制劑上市許可申請(qǐng)。一個(gè)月后,F(xiàn)DA表示,將對(duì)兩家公司的實(shí)驗(yàn)性AD藥物阿杜卡奴抗體進(jìn)行快速審查,而這也是FDA 17年來(lái)首次審查治療這種精神疾病類(lèi)藥物的申請(qǐng)。
進(jìn)入快速審查通道意味著FDA將于明年3月7日對(duì)該藥物的上市批準(zhǔn)作出決定,這比標(biāo)準(zhǔn)審查通常預(yù)期的10個(gè)月要更快。受該消息提振,渤健當(dāng)天的股價(jià)截至收盤(pán)時(shí)上漲了10%。
如今,無(wú)論是即將來(lái)臨的審批,還是背景文件里的初步認(rèn)可,都足以讓渤健興奮不已。
值得一提的是,F(xiàn)DA通常會(huì)遵循咨詢(xún)委員會(huì)的建議來(lái)審批藥物。而在此前不久,F(xiàn)DA剛剛將11人外部專(zhuān)家咨詢(xún)小組中一位持批評(píng)意見(jiàn)的成員驅(qū)除,該成員為梅奧診所的臨床神經(jīng)病學(xué)家大衛(wèi)·諾普曼博士,他的名字已經(jīng)從FDA外部專(zhuān)家顧問(wèn)預(yù)備會(huì)議上被撤下。
數(shù)據(jù)爭(zhēng)議
不過(guò),也不可高興得太早,畢竟,審批流程還未開(kāi)始,F(xiàn)DA的態(tài)度也無(wú)從明確得知。在AD藥物領(lǐng)域,F(xiàn)DA一直沒(méi)有松口,自2003年以來(lái),F(xiàn)DA尚未批準(zhǔn)任何有關(guān)治療AD的新藥。更何況,渤健阿杜卡奴抗體的數(shù)據(jù)還存在爭(zhēng)議。
比如被剔除的大衛(wèi)·諾普曼就對(duì)試驗(yàn)數(shù)據(jù)有質(zhì)疑。諾普曼參與了這款藥物的臨床試驗(yàn),上周日,他在一篇論文中寫(xiě)道,“阿杜卡奴單抗治療阿爾茨海默癥認(rèn)知功能障礙的功效無(wú)法通過(guò)臨床試驗(yàn)得出不同的結(jié)果”,并呼吁渤健進(jìn)行另外的第三階段試驗(yàn)。
除了諾普曼的質(zhì)疑之外,F(xiàn)DA也有統(tǒng)計(jì)專(zhuān)家稱(chēng)渤健的分析數(shù)據(jù)存在缺陷,并不能證明阿杜卡奴抗體的有效性。
事實(shí)上,在研發(fā)路上,渤健也經(jīng)歷了挫折。渤健很早之前就開(kāi)始了阿杜卡奴抗體的試驗(yàn),2017年10月,渤健和衛(wèi)材開(kāi)始就這款藥物的開(kāi)發(fā)和商業(yè)化展開(kāi)合作。
去年3月,渤健和衛(wèi)材宣布,由于臨床數(shù)據(jù)令人失望,他們將停止這款針對(duì)AD輕度認(rèn)知障礙患者的藥物的全球III期臨床試驗(yàn)。根據(jù)渤健的說(shuō)法,在分析了截至2018年12月26日的來(lái)自1748名患者的數(shù)據(jù)之后,相關(guān)研究在完成后不太可能達(dá)到預(yù)期效果。
但到了去年10月,兩家公司又宣布,在與FDA討論并進(jìn)一步分析更大量的數(shù)據(jù)之后,他們將尋求對(duì)該藥物的監(jiān)管批準(zhǔn)。
即便有過(guò)失敗的經(jīng)歷,即便臨床數(shù)據(jù)仍然無(wú)法讓所有審查者滿(mǎn)意,但渤健的進(jìn)展仍然讓外界看到了一絲希望,華爾街已經(jīng)用實(shí)際行動(dòng)表明了態(tài)度。富國(guó)證券分析師Jim Birchenough表示,盡管FDA的最終結(jié)果難以預(yù)測(cè),但相信會(huì)議上將會(huì)有更多積極的建議,預(yù)計(jì)周五的咨詢(xún)委員會(huì)將建議批準(zhǔn)通過(guò)該新藥,并將渤健評(píng)級(jí)由“持有”上調(diào)至“買(mǎi)入”,同時(shí)將其目標(biāo)價(jià)上調(diào)至390美元。
難在哪
FDA短短的幾個(gè)字,就讓渤健的股價(jià)飆升了40%,也扭轉(zhuǎn)了華爾街的態(tài)度,足見(jiàn)市場(chǎng)對(duì)于AD藥物的期待。
國(guó)際阿爾茨海默癥協(xié)會(huì)發(fā)布的《2018年世界阿爾茨海默癥報(bào)告》顯示,截至2018年,全球共有5000萬(wàn)AD患者,社會(huì)相關(guān)成本達(dá)1萬(wàn)億美元,而隨著人口老齡化的趨勢(shì),預(yù)計(jì)到2030年全球AD患者將會(huì)達(dá)到8200萬(wàn)人,2050年將達(dá)到1.52億人。
“從西醫(yī)的邏輯講,必須清晰病理機(jī)制,然后有與之相對(duì)應(yīng)的藥理,達(dá)到治療目的。如果病理機(jī)制清晰,獲批還是有可能的。”中國(guó)中醫(yī)科學(xué)院中醫(yī)學(xué)副教授孫海舒指出。
不過(guò),由于AD發(fā)病機(jī)制尚未明確,現(xiàn)有藥物均只能緩解臨床癥狀,改善或逆轉(zhuǎn)AD進(jìn)程的藥物尚未出現(xiàn)。“阿爾茨海默癥很難真正治愈,其誘因可能有多種,還有適應(yīng)癥的問(wèn)題,最多只能是延緩。”醫(yī)療戰(zhàn)略咨詢(xún)公司LatitudeHealth創(chuàng)始人趙衡坦言。
抗體藥物研發(fā)總監(jiān)閆閏告訴北京商報(bào)記者,阿爾茲海默癥的發(fā)病機(jī)制至今沒(méi)有定論。之前多年此研究領(lǐng)域傾向于認(rèn)為beta-amyloid是致病根源,但是隨著針對(duì)減少beta-amyloid產(chǎn)生的臨床藥物相繼折戟,學(xué)界業(yè)界也開(kāi)始重新審視此理論。而如果連發(fā)病機(jī)制都無(wú)法確定,開(kāi)發(fā)治療藥物就更難上加難了。
除了上述原因以外,閆閏還提到了其他因素,包括科研模型和臨床標(biāo)準(zhǔn)等等。以臨床標(biāo)準(zhǔn)為例,閆閏稱(chēng),早期FDA的臨床藥效判定標(biāo)準(zhǔn)是對(duì)認(rèn)知能力和記憶的改善。但早期阿爾茲海默癥患者并沒(méi)有這兩個(gè)方面的表現(xiàn),而晚期的重癥患者如果藥物效果不夠強(qiáng)又很難展示出藥物的療效,從而造成大量藥物在臨床階段折戟。FDA已經(jīng)調(diào)整判定標(biāo)準(zhǔn),把biomarker的改變納入判斷標(biāo)準(zhǔn)。但biomarker本身的確定和檢測(cè)又是一個(gè)難點(diǎn)。
此外,閆閏還指出,神經(jīng)類(lèi)疾病是傳統(tǒng)難攻的領(lǐng)域,因?yàn)檠X屏障的存在,以及大腦自有的獨(dú)特免疫系統(tǒng),中樞神經(jīng)系統(tǒng)疾病一直是藥物研發(fā)的困難領(lǐng)域。隨著對(duì)大腦的深入研究,也慢慢展示出大腦各區(qū)域的異質(zhì)性,每個(gè)功能區(qū)域?qū)λ幬镯憫?yīng)可能不同,也就加大了系統(tǒng)治療的難度。
據(jù)了解,目前全球獲批用于臨床治療的藥物只有5款,即多奈哌齊、卡巴拉汀、加蘭他敏、美金剛以及多奈哌齊+美金剛復(fù)方制劑。不過(guò),這些藥物主要作用機(jī)制為膽堿酯酶抑制劑或NMDA拮抗劑,只能達(dá)到改善腦血流量,促進(jìn)腦認(rèn)知功能恢復(fù)的作用,無(wú)法徹底根治老年癡呆。
不是沒(méi)有藥企努力過(guò)。在過(guò)去20多年來(lái),全球各大制藥公司相繼投入了數(shù)千億美元研發(fā)藥物,美國(guó)藥品研究與制造商協(xié)會(huì)2018年發(fā)布的報(bào)告指出,在1998-2017年期間,全球已有146個(gè)AD藥物在臨床中遭遇失敗,僅有4個(gè)藥物成功上市;同時(shí),幾乎所有靶向β-淀粉樣蛋白的治療策略在臨床試驗(yàn)中也全軍覆沒(méi)。AD新藥研發(fā)失敗率高達(dá)99.6%。
趙衡表示,“大家認(rèn)為這個(gè)市場(chǎng)很大,也在持續(xù)投入,但總體上來(lái)看,沒(méi)有龍頭藥物,且新藥的失敗率太高了”。
去年3月,渤健宣布終止臨床試驗(yàn)之后,大多數(shù)研究人員和生物技術(shù)公司的高管都認(rèn)為,盡管阿爾茨海默癥的病例在不斷增加,但他們幾乎看不到任何希望能夠研制出一種能夠幫助患者的藥物。
因此,阿杜卡奴抗體一度被認(rèn)為是阿爾茨海默癥最后的希望。對(duì)于相關(guān)的實(shí)驗(yàn)數(shù)據(jù)、審批流程等情況,北京商報(bào)記者聯(lián)系了渤健方面,不過(guò)截至發(fā)稿還未收到回復(fù)。
值得一提的是,除了阿杜卡奴抗體,去年11月,由上海藥物研究所和上海綠谷制藥累計(jì)投入4億美元共同研發(fā)的阿爾茨海默癥原創(chuàng)新藥——“九期一”甘露特鈉膠囊(GV-971)獲得中國(guó)國(guó)家藥品監(jiān)督管理局有條件批準(zhǔn),并在國(guó)內(nèi)正式上市。該藥物用于輕度至中度阿爾茨海默癥,改善患者認(rèn)知功能。今年4月,F(xiàn)DA批準(zhǔn)“九期一”開(kāi)始在北美、歐盟等地開(kāi)展臨床試驗(yàn),預(yù)計(jì)2024年完成。
標(biāo)簽: 渤健
-
 天津知識(shí)產(chǎn)權(quán)保護(hù)體系進(jìn)一步完善 高效益加快知識(shí)產(chǎn)權(quán)價(jià)值實(shí)現(xiàn) 市政府新聞辦昨天召開(kāi)新聞發(fā)布會(huì),發(fā)布《2021年天津市知識(shí)產(chǎn)權(quán)發(fā)展?fàn)顩r白皮書(shū)》和《2021年天津市知識(shí)產(chǎn)權(quán)保護(hù)狀況白皮書(shū)》。記者從發(fā)布會(huì)上
天津知識(shí)產(chǎn)權(quán)保護(hù)體系進(jìn)一步完善 高效益加快知識(shí)產(chǎn)權(quán)價(jià)值實(shí)現(xiàn) 市政府新聞辦昨天召開(kāi)新聞發(fā)布會(huì),發(fā)布《2021年天津市知識(shí)產(chǎn)權(quán)發(fā)展?fàn)顩r白皮書(shū)》和《2021年天津市知識(shí)產(chǎn)權(quán)保護(hù)狀況白皮書(shū)》。記者從發(fā)布會(huì)上 -
 下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率 提升金融機(jī)構(gòu)外匯資金運(yùn)用能力 據(jù)央行網(wǎng)站4月25日晚間消息,為提升金融機(jī)構(gòu)外匯資金運(yùn)用能力,中國(guó)人民銀行決定,自2022年5月15日起,下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率1個(gè)百
下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率 提升金融機(jī)構(gòu)外匯資金運(yùn)用能力 據(jù)央行網(wǎng)站4月25日晚間消息,為提升金融機(jī)構(gòu)外匯資金運(yùn)用能力,中國(guó)人民銀行決定,自2022年5月15日起,下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率1個(gè)百 -
 鋼鐵行業(yè)受供給約束成本持續(xù)上升 提高經(jīng)濟(jì)效益難度增大 今年一季度,中國(guó)鋼鐵行業(yè)受供給約束、需求收縮、成本上升等因素影響,營(yíng)收利潤(rùn)出現(xiàn)下降。4月25日,中國(guó)鋼鐵工業(yè)協(xié)會(huì)舉行2022年一季度信息
鋼鐵行業(yè)受供給約束成本持續(xù)上升 提高經(jīng)濟(jì)效益難度增大 今年一季度,中國(guó)鋼鐵行業(yè)受供給約束、需求收縮、成本上升等因素影響,營(yíng)收利潤(rùn)出現(xiàn)下降。4月25日,中國(guó)鋼鐵工業(yè)協(xié)會(huì)舉行2022年一季度信息 -
 完美世界高開(kāi)高走 公司游戲研發(fā)升級(jí)轉(zhuǎn)型已見(jiàn)成效 4月26日早盤(pán),完美世界高開(kāi)高走。截至發(fā)稿已封死漲停,漲停板封單接近25萬(wàn)手之巨。消息面,4月25日晚間完美世界發(fā)布2021年年報(bào)及2022年第一
完美世界高開(kāi)高走 公司游戲研發(fā)升級(jí)轉(zhuǎn)型已見(jiàn)成效 4月26日早盤(pán),完美世界高開(kāi)高走。截至發(fā)稿已封死漲停,漲停板封單接近25萬(wàn)手之巨。消息面,4月25日晚間完美世界發(fā)布2021年年報(bào)及2022年第一 -
 北京商超通過(guò)產(chǎn)地直采調(diào)貨機(jī)制緊急增加貨量 保障市場(chǎng)供應(yīng)穩(wěn)定 面對(duì)突發(fā)的疫情,北京各大商超企業(yè)迅速開(kāi)啟了保供模式。4月24日,北京商報(bào)記者從多家商超企業(yè)了解到,針對(duì)北京市突發(fā)局部疫情,多家超市企
北京商超通過(guò)產(chǎn)地直采調(diào)貨機(jī)制緊急增加貨量 保障市場(chǎng)供應(yīng)穩(wěn)定 面對(duì)突發(fā)的疫情,北京各大商超企業(yè)迅速開(kāi)啟了保供模式。4月24日,北京商報(bào)記者從多家商超企業(yè)了解到,針對(duì)北京市突發(fā)局部疫情,多家超市企 -
 農(nóng)村“一刻鐘”建模 一體化縣域商業(yè)網(wǎng)絡(luò)體系升級(jí) 北京的便民商業(yè)網(wǎng)點(diǎn)建設(shè)已從市區(qū)延伸到郊區(qū)。4月24日,北京商報(bào)記者從北京市商務(wù)局了解到,北京農(nóng)村地區(qū)便民商業(yè)網(wǎng)點(diǎn)改造提升典型示范類(lèi)項(xiàng)
農(nóng)村“一刻鐘”建模 一體化縣域商業(yè)網(wǎng)絡(luò)體系升級(jí) 北京的便民商業(yè)網(wǎng)點(diǎn)建設(shè)已從市區(qū)延伸到郊區(qū)。4月24日,北京商報(bào)記者從北京市商務(wù)局了解到,北京農(nóng)村地區(qū)便民商業(yè)網(wǎng)點(diǎn)改造提升典型示范類(lèi)項(xiàng)
-
 傳祺影豹驚艷不止一點(diǎn),造型設(shè)計(jì)再獲權(quán)威認(rèn)證 4月26日,中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典頒獎(jiǎng)典禮在京拉開(kāi)序幕。參加本次盛典候選名單的車(chē)型有近一千款優(yōu)秀汽車(chē)產(chǎn)品,不乏包括2021
傳祺影豹驚艷不止一點(diǎn),造型設(shè)計(jì)再獲權(quán)威認(rèn)證 4月26日,中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典頒獎(jiǎng)典禮在京拉開(kāi)序幕。參加本次盛典候選名單的車(chē)型有近一千款優(yōu)秀汽車(chē)產(chǎn)品,不乏包括2021 -
 近8萬(wàn)師生擠爆直播間,毓婷學(xué)院獎(jiǎng)創(chuàng)意課堂全國(guó)場(chǎng)火熱開(kāi)講! 3月29日到4月26日毓婷攜手學(xué)院獎(jiǎng),開(kāi)啟10場(chǎng)線(xiàn)上巡講來(lái)自北京、天津、河南、山西內(nèi)蒙、甘肅、山東、上海、安徽遼寧、云南、廣東等27個(gè)省市的
近8萬(wàn)師生擠爆直播間,毓婷學(xué)院獎(jiǎng)創(chuàng)意課堂全國(guó)場(chǎng)火熱開(kāi)講! 3月29日到4月26日毓婷攜手學(xué)院獎(jiǎng),開(kāi)啟10場(chǎng)線(xiàn)上巡講來(lái)自北京、天津、河南、山西內(nèi)蒙、甘肅、山東、上海、安徽遼寧、云南、廣東等27個(gè)省市的 - 崔東樹(shù):以A00級(jí)產(chǎn)品切入新能源乘用車(chē),曙光汽車(chē)未來(lái)可期 新能源汽車(chē)被公認(rèn)為全球汽車(chē)產(chǎn)業(yè)唯一可見(jiàn)的未來(lái)發(fā)展方向。在各國(guó)加速新能源產(chǎn)業(yè)布局的基礎(chǔ)上,中國(guó)新能源汽車(chē)市場(chǎng)呈現(xiàn)出量級(jí)增長(zhǎng)的態(tài)勢(shì),包
-
 圣奧化學(xué)加入“攜手可持續(xù)發(fā)展”(TfS)倡議 4月27日,全球性倡議組織攜手可持續(xù)發(fā)展(Together for Sustainability,簡(jiǎn)稱(chēng)TfS)宣布,圣奧化學(xué)科技有限公司(簡(jiǎn)稱(chēng)圣奧化學(xué))正式加入Tf
圣奧化學(xué)加入“攜手可持續(xù)發(fā)展”(TfS)倡議 4月27日,全球性倡議組織攜手可持續(xù)發(fā)展(Together for Sustainability,簡(jiǎn)稱(chēng)TfS)宣布,圣奧化學(xué)科技有限公司(簡(jiǎn)稱(chēng)圣奧化學(xué))正式加入Tf - 菜鳥(niǎo)在北京封控區(qū)推24小時(shí)配送 記者從菜鳥(niǎo)了解到,該物流企業(yè)在京運(yùn)力將向封控區(qū)和管控區(qū)做一定傾斜,優(yōu)先保證這些風(fēng)險(xiǎn)區(qū)域的消費(fèi)者及時(shí)收貨。目前菜鳥(niǎo)已在封控區(qū)推出24小
-
 【正式啟用】| 匯聚行業(yè)資源·打造共贏的義烏市跨境電商服務(wù)中心勁爆來(lái)襲 目前,義烏市跨境電商綜合服務(wù)中心(以下簡(jiǎn)稱(chēng)服務(wù)中心)已正式啟用。義烏是一座建在市場(chǎng)上的城市,每天,有數(shù)十萬(wàn)名中外客商在這里洽談生意
【正式啟用】| 匯聚行業(yè)資源·打造共贏的義烏市跨境電商服務(wù)中心勁爆來(lái)襲 目前,義烏市跨境電商綜合服務(wù)中心(以下簡(jiǎn)稱(chēng)服務(wù)中心)已正式啟用。義烏是一座建在市場(chǎng)上的城市,每天,有數(shù)十萬(wàn)名中外客商在這里洽談生意 -
 Lavinia | 重回自然,浪漫繁花 隨著自然危機(jī)的加深,環(huán)保口號(hào)的聲音也越來(lái)越多,人與自然,科技與自然成為各行各業(yè)研究的方向。Lavinia2022夏季的新品系列,也大量的采用
Lavinia | 重回自然,浪漫繁花 隨著自然危機(jī)的加深,環(huán)保口號(hào)的聲音也越來(lái)越多,人與自然,科技與自然成為各行各業(yè)研究的方向。Lavinia2022夏季的新品系列,也大量的采用 - 協(xié)助解除彈窗、分發(fā)物資 北京鏈家志愿者加入潘家園、勁松防疫 近日,北京市朝陽(yáng)區(qū)潘家園街道、勁松街道等地成為重點(diǎn)防疫區(qū)域。作為房產(chǎn)經(jīng)紀(jì)人志愿者,北京鏈家志愿者們紛紛加入社區(qū)防疫隊(duì)伍,在攜手抗擊
-
 深睡為奪冠蓄能!顧家家居首批顧家深睡床墊交付亞運(yùn)村! 亞運(yùn)的腳步越來(lái)越近,56個(gè)競(jìng)賽場(chǎng)館都已竣工驗(yàn)收,亞運(yùn)村也進(jìn)入裝修掃尾工作,坐落于錢(qián)塘江南岸的杭州亞運(yùn)村,賽時(shí)將為各國(guó)運(yùn)動(dòng)員、隨隊(duì)官員
深睡為奪冠蓄能!顧家家居首批顧家深睡床墊交付亞運(yùn)村! 亞運(yùn)的腳步越來(lái)越近,56個(gè)競(jìng)賽場(chǎng)館都已竣工驗(yàn)收,亞運(yùn)村也進(jìn)入裝修掃尾工作,坐落于錢(qián)塘江南岸的杭州亞運(yùn)村,賽時(shí)將為各國(guó)運(yùn)動(dòng)員、隨隊(duì)官員 -
 美呀植牙史競(jìng)醫(yī)術(shù)高超,仁醫(yī)仁術(shù)贏口碑 美呀植牙是國(guó)內(nèi)領(lǐng)先的全國(guó)口腔連鎖機(jī)構(gòu),專(zhuān)注口腔種植領(lǐng)域,目前在全國(guó)一二線(xiàn)城市19城建立26家自營(yíng)門(mén)診。從成立之初,美呀植牙就以讓所有老
美呀植牙史競(jìng)醫(yī)術(shù)高超,仁醫(yī)仁術(shù)贏口碑 美呀植牙是國(guó)內(nèi)領(lǐng)先的全國(guó)口腔連鎖機(jī)構(gòu),專(zhuān)注口腔種植領(lǐng)域,目前在全國(guó)一二線(xiàn)城市19城建立26家自營(yíng)門(mén)診。從成立之初,美呀植牙就以讓所有老 - 元道經(jīng)緯相機(jī)六周年,引領(lǐng)全行業(yè)現(xiàn)場(chǎng)拍照 4月27日,元道經(jīng)緯相機(jī)上線(xiàn)六周年之際,重磅發(fā)布了致所有用戶(hù)的一封信,信中既展示了這六年來(lái)的成績(jī)單,也向所有用戶(hù)講述了六年來(lái)的的成長(zhǎng)
-
 服務(wù)企業(yè)更好出海,大龍網(wǎng)攜手歐中跨境電商協(xié)會(huì)舉辦歐盟法律專(zhuān)場(chǎng)培訓(xùn)會(huì) 4月20日,由歐中跨境電商協(xié)會(huì)主辦,聯(lián)合荷蘭凱拓國(guó)際律師事務(wù)所,成功舉辦了以商業(yè)合同和產(chǎn)品合規(guī)性為主題的線(xiàn)上歐洲法律專(zhuān)場(chǎng)培訓(xùn)會(huì)。培訓(xùn)
服務(wù)企業(yè)更好出海,大龍網(wǎng)攜手歐中跨境電商協(xié)會(huì)舉辦歐盟法律專(zhuān)場(chǎng)培訓(xùn)會(huì) 4月20日,由歐中跨境電商協(xié)會(huì)主辦,聯(lián)合荷蘭凱拓國(guó)際律師事務(wù)所,成功舉辦了以商業(yè)合同和產(chǎn)品合規(guī)性為主題的線(xiàn)上歐洲法律專(zhuān)場(chǎng)培訓(xùn)會(huì)。培訓(xùn) - 顧家家居推出79800套餐有市場(chǎng)嗎?艾瑞咨詢(xún)報(bào)告或許給出了答案 整家或者全屋定制套餐,是否只能走客單均價(jià)2~3萬(wàn)元的絕對(duì)性?xún)r(jià)比路線(xiàn)?相信很多人都有這種想法,筆者本人也曾經(jīng)這樣認(rèn)為。但仔細(xì)一想,這種
-
 上海保供有一條“助老通道”,20天為2萬(wàn)老人送達(dá)生活物資 疫情期間,物流運(yùn)力緊張,保供壓力大。而面對(duì)老年人這一特殊群體,他們不擅長(zhǎng)使用手機(jī)網(wǎng)購(gòu),有些高齡老人長(zhǎng)期住在養(yǎng)老院,需要穩(wěn)定的食品營(yíng)養(yǎng)補(bǔ)
上海保供有一條“助老通道”,20天為2萬(wàn)老人送達(dá)生活物資 疫情期間,物流運(yùn)力緊張,保供壓力大。而面對(duì)老年人這一特殊群體,他們不擅長(zhǎng)使用手機(jī)網(wǎng)購(gòu),有些高齡老人長(zhǎng)期住在養(yǎng)老院,需要穩(wěn)定的食品營(yíng)養(yǎng)補(bǔ) - 首個(gè)通過(guò)GCP功效驗(yàn)證的沖牙器品牌!倍至推動(dòng)口腔護(hù)理行業(yè)走進(jìn)專(zhuān)業(yè)化時(shí)代 從1922年中國(guó)第一支牙膏——三星牙膏誕生,開(kāi)啟本土牙膏業(yè)的發(fā)展,到如今各式各樣的牙膏、漱口水、口腔噴霧、牙貼、口腔爆珠等產(chǎn)品百花...
-
 美麗岸,西雅圖現(xiàn)房海景公寓,享盡太平洋艾略特灣之美 美亞置業(yè)西雅圖海景現(xiàn)房公寓,THE EMERALD 美麗岸,享盡太平洋艾略特灣之美就像西雅圖市中心天際線(xiàn)上的一顆寶石,高達(dá)40層的西雅圖現(xiàn)房海
美麗岸,西雅圖現(xiàn)房海景公寓,享盡太平洋艾略特灣之美 美亞置業(yè)西雅圖海景現(xiàn)房公寓,THE EMERALD 美麗岸,享盡太平洋艾略特灣之美就像西雅圖市中心天際線(xiàn)上的一顆寶石,高達(dá)40層的西雅圖現(xiàn)房海 -
 知名數(shù)字資產(chǎn)交易平臺(tái)8V與Onramper達(dá)成合作,強(qiáng)強(qiáng)賦能OTC業(yè)務(wù) 近日,知名元宇宙生態(tài)數(shù)字資產(chǎn)交易平臺(tái)8V隆重宣布與全球領(lǐng)先的OTC服務(wù)商O(píng)nramper達(dá)成戰(zhàn)略合作,完了技術(shù)對(duì)接并正式上線(xiàn)OTC業(yè)務(wù)。此次合作帶來(lái)
知名數(shù)字資產(chǎn)交易平臺(tái)8V與Onramper達(dá)成合作,強(qiáng)強(qiáng)賦能OTC業(yè)務(wù) 近日,知名元宇宙生態(tài)數(shù)字資產(chǎn)交易平臺(tái)8V隆重宣布與全球領(lǐng)先的OTC服務(wù)商O(píng)nramper達(dá)成戰(zhàn)略合作,完了技術(shù)對(duì)接并正式上線(xiàn)OTC業(yè)務(wù)。此次合作帶來(lái) -
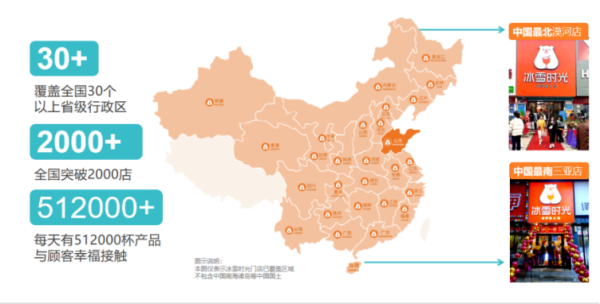 奶茶行業(yè)品牌多、競(jìng)爭(zhēng)大 冰雪時(shí)光靠什么贏得掌聲? 隨著頭部品牌的下沉,新式茶飲行業(yè)競(jìng)爭(zhēng)愈發(fā)激烈。為了搶占更多市場(chǎng)份額,各大高端茶飲品牌不斷拓寬價(jià)格帶,紛紛推出平價(jià)系列產(chǎn)品。即便如此
奶茶行業(yè)品牌多、競(jìng)爭(zhēng)大 冰雪時(shí)光靠什么贏得掌聲? 隨著頭部品牌的下沉,新式茶飲行業(yè)競(jìng)爭(zhēng)愈發(fā)激烈。為了搶占更多市場(chǎng)份額,各大高端茶飲品牌不斷拓寬價(jià)格帶,紛紛推出平價(jià)系列產(chǎn)品。即便如此 -
 原料新鮮 用料扎實(shí) 冰雪時(shí)光穩(wěn)扎茶飲下沉市場(chǎng) 近些年來(lái),隨著人們生活水平的提高,美團(tuán)、餓了么等外賣(mài)平臺(tái)盛行,新式茶飲行業(yè)迎來(lái)快速發(fā)展。數(shù)據(jù)顯示,我國(guó)在業(yè) 存續(xù)奶茶相關(guān)企業(yè)已經(jīng)達(dá)
原料新鮮 用料扎實(shí) 冰雪時(shí)光穩(wěn)扎茶飲下沉市場(chǎng) 近些年來(lái),隨著人們生活水平的提高,美團(tuán)、餓了么等外賣(mài)平臺(tái)盛行,新式茶飲行業(yè)迎來(lái)快速發(fā)展。數(shù)據(jù)顯示,我國(guó)在業(yè) 存續(xù)奶茶相關(guān)企業(yè)已經(jīng)達(dá) - 住建部科技示范“立體園林綠色建筑”健康中國(guó)創(chuàng)意城市在京簽約 視日前,住建部科技項(xiàng)目立體園林綠色建筑與健康中國(guó)創(chuàng)意城市示范工程合作簽約儀式在住建部科技與產(chǎn)業(yè)化發(fā)展中心舉行。住建部科技與產(chǎn)業(yè)化發(fā)
-
 洪森總理會(huì)見(jiàn)太子集團(tuán)董事長(zhǎng)陳志 昨日,洪森總理在和平大廈會(huì)見(jiàn)太子集團(tuán)控股陳志公爵率領(lǐng)的從事礦業(yè)、房地產(chǎn)、貿(mào)易,物流和證券的投資企業(yè)代表。此次訪(fǎng)問(wèn)還反映了陳志公爵和
洪森總理會(huì)見(jiàn)太子集團(tuán)董事長(zhǎng)陳志 昨日,洪森總理在和平大廈會(huì)見(jiàn)太子集團(tuán)控股陳志公爵率領(lǐng)的從事礦業(yè)、房地產(chǎn)、貿(mào)易,物流和證券的投資企業(yè)代表。此次訪(fǎng)問(wèn)還反映了陳志公爵和 - 蜜雪冰城:攻守結(jié)合 知產(chǎn)保護(hù)走在前 你愛(ài)我呀我愛(ài)你,蜜雪冰城甜蜜蜜……這首歌傳遍大街小巷。氣溫升高,來(lái)杯蜜雪冰城的檸檬水,再愜意不過(guò)。近年來(lái),蜜雪冰城深耕下沉市場(chǎng)...
-
 嵐圖FREE實(shí)力登頂 東風(fēng)公司斬獲中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典四項(xiàng)大獎(jiǎng) 4月26日,由中央廣播電視總臺(tái)主辦、總臺(tái)財(cái)經(jīng)節(jié)目中心特別策劃的中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典落下帷幕。憑借過(guò)硬實(shí)力,東風(fēng)汽車(chē)
嵐圖FREE實(shí)力登頂 東風(fēng)公司斬獲中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典四項(xiàng)大獎(jiǎng) 4月26日,由中央廣播電視總臺(tái)主辦、總臺(tái)財(cái)經(jīng)節(jié)目中心特別策劃的中央廣播電視總臺(tái)·2021中國(guó)汽車(chē)風(fēng)云盛典落下帷幕。憑借過(guò)硬實(shí)力,東風(fēng)汽車(chē) -
 廣州加拿達(dá)外國(guó)語(yǔ)學(xué)校——“雙出口”給孩子更多選擇 很多家長(zhǎng)在選擇學(xué)校時(shí),都有一個(gè)需求,他們希望孩子有一個(gè)雙出口,在高中階段升學(xué)時(shí),既可以走國(guó)內(nèi)升學(xué)之路,也可以走國(guó)際教育之路。雙出口留給
廣州加拿達(dá)外國(guó)語(yǔ)學(xué)校——“雙出口”給孩子更多選擇 很多家長(zhǎng)在選擇學(xué)校時(shí),都有一個(gè)需求,他們希望孩子有一個(gè)雙出口,在高中階段升學(xué)時(shí),既可以走國(guó)內(nèi)升學(xué)之路,也可以走國(guó)際教育之路。雙出口留給 -
 INOT1發(fā)行新專(zhuān)輯《沖天志》NUMBER K COMPANY參與制作 最近INOT1用中文和英文發(fā)行了包含主打歌一杯火焰在內(nèi)的新專(zhuān)輯《沖天之志》, 受到廣大粉絲的熱烈歡迎。據(jù)悉,參與制作INTO1出道專(zhuān)輯的NUMBE
INOT1發(fā)行新專(zhuān)輯《沖天志》NUMBER K COMPANY參與制作 最近INOT1用中文和英文發(fā)行了包含主打歌一杯火焰在內(nèi)的新專(zhuān)輯《沖天之志》, 受到廣大粉絲的熱烈歡迎。據(jù)悉,參與制作INTO1出道專(zhuān)輯的NUMBE - 盈康生命財(cái)報(bào)暗藏轉(zhuǎn)機(jī),聰明資金增持 4月25日,盈康生命科技股份有限公司(簡(jiǎn)稱(chēng):盈康生命,代碼:300143 SZ)發(fā)布業(yè)績(jī)預(yù)告,預(yù)計(jì)2021年?duì)I業(yè)收入實(shí)現(xiàn)110,000萬(wàn)元,重組前口徑同
-
 外匯天眼:外匯交易中出金有問(wèn)題,如何正確維權(quán)? 關(guān)注外匯天眼的投資者一定經(jīng)常到天眼君發(fā)布《成功到賬》系列的文章,在這些文章中遭遇了外匯出金問(wèn)題的投資者都如愿拿到了自己被拖延的資金
外匯天眼:外匯交易中出金有問(wèn)題,如何正確維權(quán)? 關(guān)注外匯天眼的投資者一定經(jīng)常到天眼君發(fā)布《成功到賬》系列的文章,在這些文章中遭遇了外匯出金問(wèn)題的投資者都如愿拿到了自己被拖延的資金 -
 彌玥泉噴霧丨媽生好皮的底妝秘訣,終于跟化妝師學(xué)會(huì)了 陽(yáng)光正好,微風(fēng)不燥,一顆瘋狂想外出的心早就按捺不住了,這樣的好天氣,不化個(gè)美美的妝、約個(gè)三五好友賞花看景,簡(jiǎn)直就是辜負(fù)好時(shí)光呀!不過(guò),對(duì)
彌玥泉噴霧丨媽生好皮的底妝秘訣,終于跟化妝師學(xué)會(huì)了 陽(yáng)光正好,微風(fēng)不燥,一顆瘋狂想外出的心早就按捺不住了,這樣的好天氣,不化個(gè)美美的妝、約個(gè)三五好友賞花看景,簡(jiǎn)直就是辜負(fù)好時(shí)光呀!不過(guò),對(duì) -
 2022廣州從化區(qū)幼兒園報(bào)名 小區(qū)從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間公布 ?小區(qū)配套幼兒園從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間:4月28日至30日上午9:00-12:00,下午14:30-17:30注:小區(qū)從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間,符合條件的
2022廣州從化區(qū)幼兒園報(bào)名 小區(qū)從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間公布 ?小區(qū)配套幼兒園從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間:4月28日至30日上午9:00-12:00,下午14:30-17:30注:小區(qū)從化戶(hù)籍業(yè)主子女報(bào)名時(shí)間,符合條件的 -
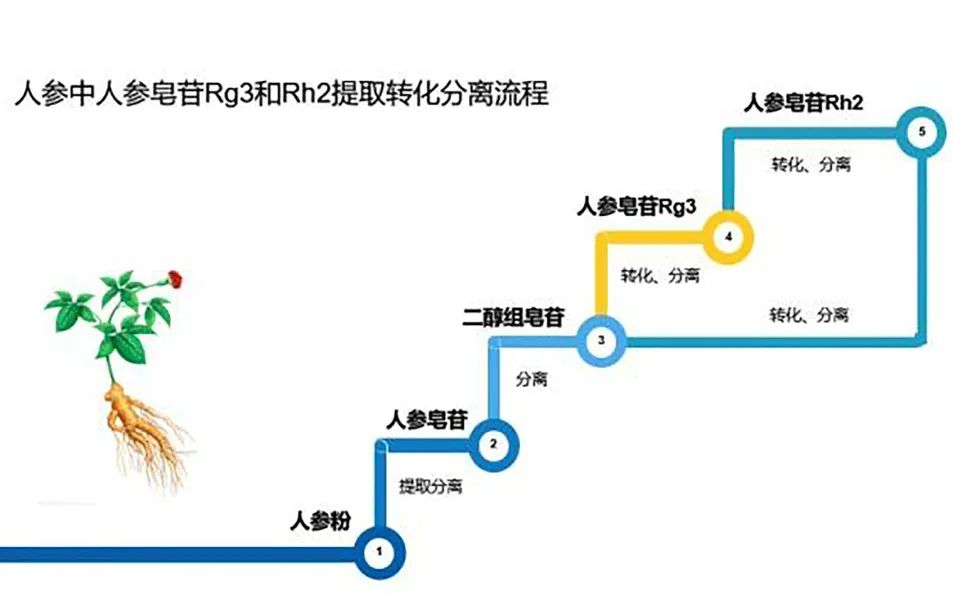 安普膠囊人參皂苷產(chǎn)品,抗癌修復(fù)、增強(qiáng)免疫的天然護(hù)命素! 人參自古即有「百草之王」之稱(chēng),居中國(guó)四大補(bǔ)品之首,一直以來(lái)都備受推崇。其主要有大補(bǔ)元?dú)猓采褚嬷恰?fù)脈固脫,補(bǔ)脾益肺,生津止渴等來(lái)
安普膠囊人參皂苷產(chǎn)品,抗癌修復(fù)、增強(qiáng)免疫的天然護(hù)命素! 人參自古即有「百草之王」之稱(chēng),居中國(guó)四大補(bǔ)品之首,一直以來(lái)都備受推崇。其主要有大補(bǔ)元?dú)猓采褚嬷恰?fù)脈固脫,補(bǔ)脾益肺,生津止渴等來(lái) -
 天津知識(shí)產(chǎn)權(quán)保護(hù)體系進(jìn)一步完善 高效益加快知識(shí)產(chǎn)權(quán)價(jià)值實(shí)現(xiàn) 市政府新聞辦昨天召開(kāi)新聞發(fā)布會(huì),發(fā)布《2021年天津市知識(shí)產(chǎn)權(quán)發(fā)展?fàn)顩r白皮書(shū)》和《2021年天津市知識(shí)產(chǎn)權(quán)保護(hù)狀況白皮書(shū)》。記者從發(fā)布會(huì)上
天津知識(shí)產(chǎn)權(quán)保護(hù)體系進(jìn)一步完善 高效益加快知識(shí)產(chǎn)權(quán)價(jià)值實(shí)現(xiàn) 市政府新聞辦昨天召開(kāi)新聞發(fā)布會(huì),發(fā)布《2021年天津市知識(shí)產(chǎn)權(quán)發(fā)展?fàn)顩r白皮書(shū)》和《2021年天津市知識(shí)產(chǎn)權(quán)保護(hù)狀況白皮書(shū)》。記者從發(fā)布會(huì)上 -
 從安全相識(shí)到牽手奔現(xiàn) 愛(ài)聊闡釋了線(xiàn)上社交的四個(gè)階段 近日,由于疫情的原因,許多小情侶見(jiàn)不到面,被迫開(kāi)啟了網(wǎng)戀模式,也正因如此,關(guān)于線(xiàn)上交友的問(wèn)題,也成為了我們茶余飯后的談資。一位在愛(ài)聊APP
從安全相識(shí)到牽手奔現(xiàn) 愛(ài)聊闡釋了線(xiàn)上社交的四個(gè)階段 近日,由于疫情的原因,許多小情侶見(jiàn)不到面,被迫開(kāi)啟了網(wǎng)戀模式,也正因如此,關(guān)于線(xiàn)上交友的問(wèn)題,也成為了我們茶余飯后的談資。一位在愛(ài)聊APP -
 下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率 提升金融機(jī)構(gòu)外匯資金運(yùn)用能力 據(jù)央行網(wǎng)站4月25日晚間消息,為提升金融機(jī)構(gòu)外匯資金運(yùn)用能力,中國(guó)人民銀行決定,自2022年5月15日起,下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率1個(gè)百
下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率 提升金融機(jī)構(gòu)外匯資金運(yùn)用能力 據(jù)央行網(wǎng)站4月25日晚間消息,為提升金融機(jī)構(gòu)外匯資金運(yùn)用能力,中國(guó)人民銀行決定,自2022年5月15日起,下調(diào)金融機(jī)構(gòu)外匯存款準(zhǔn)備金率1個(gè)百 -
 蝶適-DISC,讓近視青少年擁有光明未來(lái) 近日,越發(fā)受到關(guān)注的青少年近視防控問(wèn)題有了最新的成果研究,蝶適-DISC的出現(xiàn),大放光彩,被有些消費(fèi)者稱(chēng)之為劃時(shí)代的新突破,給萬(wàn)千青少
蝶適-DISC,讓近視青少年擁有光明未來(lái) 近日,越發(fā)受到關(guān)注的青少年近視防控問(wèn)題有了最新的成果研究,蝶適-DISC的出現(xiàn),大放光彩,被有些消費(fèi)者稱(chēng)之為劃時(shí)代的新突破,給萬(wàn)千青少 -
 《現(xiàn)在就告白5》,愛(ài)情和愛(ài)好不能并存嗎? 她喜歡寵物,于是養(yǎng)了一屋子爬寵;他因少時(shí)被蛇咬過(guò),所以一直對(duì)于爬寵敬而遠(yuǎn)之。有一天,她與他相遇。在一起半年后,她主動(dòng)告知關(guān)于爬寵的
《現(xiàn)在就告白5》,愛(ài)情和愛(ài)好不能并存嗎? 她喜歡寵物,于是養(yǎng)了一屋子爬寵;他因少時(shí)被蛇咬過(guò),所以一直對(duì)于爬寵敬而遠(yuǎn)之。有一天,她與他相遇。在一起半年后,她主動(dòng)告知關(guān)于爬寵的 -
 鋼鐵行業(yè)受供給約束成本持續(xù)上升 提高經(jīng)濟(jì)效益難度增大 今年一季度,中國(guó)鋼鐵行業(yè)受供給約束、需求收縮、成本上升等因素影響,營(yíng)收利潤(rùn)出現(xiàn)下降。4月25日,中國(guó)鋼鐵工業(yè)協(xié)會(huì)舉行2022年一季度信息
鋼鐵行業(yè)受供給約束成本持續(xù)上升 提高經(jīng)濟(jì)效益難度增大 今年一季度,中國(guó)鋼鐵行業(yè)受供給約束、需求收縮、成本上升等因素影響,營(yíng)收利潤(rùn)出現(xiàn)下降。4月25日,中國(guó)鋼鐵工業(yè)協(xié)會(huì)舉行2022年一季度信息 -
 完美世界高開(kāi)高走 公司游戲研發(fā)升級(jí)轉(zhuǎn)型已見(jiàn)成效 4月26日早盤(pán),完美世界高開(kāi)高走。截至發(fā)稿已封死漲停,漲停板封單接近25萬(wàn)手之巨。消息面,4月25日晚間完美世界發(fā)布2021年年報(bào)及2022年第一
完美世界高開(kāi)高走 公司游戲研發(fā)升級(jí)轉(zhuǎn)型已見(jiàn)成效 4月26日早盤(pán),完美世界高開(kāi)高走。截至發(fā)稿已封死漲停,漲停板封單接近25萬(wàn)手之巨。消息面,4月25日晚間完美世界發(fā)布2021年年報(bào)及2022年第一 -
 同花順早盤(pán)大幅走低 一季度市場(chǎng)行情波動(dòng)較大 4月26日,同花順早盤(pán)大幅走低,一度跌超13%,報(bào)76 3元,跌超10%。4月25日,同花順披露2022年第一季度報(bào)告,公司實(shí)現(xiàn)營(yíng)業(yè)收入5 15億元,同比
同花順早盤(pán)大幅走低 一季度市場(chǎng)行情波動(dòng)較大 4月26日,同花順早盤(pán)大幅走低,一度跌超13%,報(bào)76 3元,跌超10%。4月25日,同花順披露2022年第一季度報(bào)告,公司實(shí)現(xiàn)營(yíng)業(yè)收入5 15億元,同比 -
 藥明康德強(qiáng)勢(shì)反彈 規(guī)模效應(yīng)得以進(jìn)一步顯現(xiàn) 4月26日早盤(pán),藥明康德強(qiáng)勢(shì)反彈。截至發(fā)稿報(bào)101 56元,漲3 87%,已將昨日跌幅全部收回。消息面,4月25日晚間,藥明康德披露一季報(bào),公司實(shí)
藥明康德強(qiáng)勢(shì)反彈 規(guī)模效應(yīng)得以進(jìn)一步顯現(xiàn) 4月26日早盤(pán),藥明康德強(qiáng)勢(shì)反彈。截至發(fā)稿報(bào)101 56元,漲3 87%,已將昨日跌幅全部收回。消息面,4月25日晚間,藥明康德披露一季報(bào),公司實(shí) -
 4月以來(lái)各大指數(shù)繼續(xù)震蕩下跌 醫(yī)藥龍頭股恒瑞醫(yī)藥開(kāi)盤(pán)即暴跌 今日(26日)早盤(pán),A股三大股指集體高開(kāi),滬指漲0 07%,深證成指漲0 22%,創(chuàng)業(yè)板漲0 17%。4月25日,上證指數(shù)跌破3000點(diǎn),96%以上個(gè)股下跌。在
4月以來(lái)各大指數(shù)繼續(xù)震蕩下跌 醫(yī)藥龍頭股恒瑞醫(yī)藥開(kāi)盤(pán)即暴跌 今日(26日)早盤(pán),A股三大股指集體高開(kāi),滬指漲0 07%,深證成指漲0 22%,創(chuàng)業(yè)板漲0 17%。4月25日,上證指數(shù)跌破3000點(diǎn),96%以上個(gè)股下跌。在 - 遠(yuǎn)東股份:子公司圣達(dá)電氣失控不再并表,原總經(jīng)理李民被刑事立案 遠(yuǎn)東股份(3 580, -0 19, -5 04%)昨晚公告,控股子公司圣達(dá)電氣有限公司(以下簡(jiǎn)稱(chēng)圣達(dá)電氣)原法定代表人、董事、總經(jīng)理(已解除勞動(dòng)關(guān)系)李
-
 華潤(rùn)萬(wàn)家以變化的姿態(tài)擁抱“可持續(xù)” 在第53個(gè)世界地球日到來(lái)時(shí),始終致力于引領(lǐng)消費(fèi)升級(jí),共創(chuàng)美好生活的華潤(rùn)萬(wàn)家,將可持續(xù)理念融入到日常經(jīng)營(yíng)管理中,堅(jiān)持探討更多綠色行動(dòng),
華潤(rùn)萬(wàn)家以變化的姿態(tài)擁抱“可持續(xù)” 在第53個(gè)世界地球日到來(lái)時(shí),始終致力于引領(lǐng)消費(fèi)升級(jí),共創(chuàng)美好生活的華潤(rùn)萬(wàn)家,將可持續(xù)理念融入到日常經(jīng)營(yíng)管理中,堅(jiān)持探討更多綠色行動(dòng), -
 滬指跌破3000點(diǎn)關(guān)口后再次跌破2900點(diǎn) 市場(chǎng)擔(dān)憂(yōu)情緒再起 4月25日,滬指跌破3000點(diǎn)關(guān)口,4月26日開(kāi)盤(pán),再次跌破2900點(diǎn),市場(chǎng)擔(dān)憂(yōu)情緒再起。作為資本市場(chǎng)的重要長(zhǎng)期投資者及壓艙石,險(xiǎn)資對(duì)未來(lái)市場(chǎng)怎
滬指跌破3000點(diǎn)關(guān)口后再次跌破2900點(diǎn) 市場(chǎng)擔(dān)憂(yōu)情緒再起 4月25日,滬指跌破3000點(diǎn)關(guān)口,4月26日開(kāi)盤(pán),再次跌破2900點(diǎn),市場(chǎng)擔(dān)憂(yōu)情緒再起。作為資本市場(chǎng)的重要長(zhǎng)期投資者及壓艙石,險(xiǎn)資對(duì)未來(lái)市場(chǎng)怎 -
 A股大盤(pán)跌破2900點(diǎn) 市場(chǎng)擔(dān)憂(yōu)情緒進(jìn)一步升溫 每次跌破3000點(diǎn)之后抄底的,之后基本都是贏家。看著上證指數(shù)一度跌破2900點(diǎn)后反彈,深圳一位私募人士向第一財(cái)經(jīng)記者表示。雖然上證指數(shù)多年
A股大盤(pán)跌破2900點(diǎn) 市場(chǎng)擔(dān)憂(yōu)情緒進(jìn)一步升溫 每次跌破3000點(diǎn)之后抄底的,之后基本都是贏家。看著上證指數(shù)一度跌破2900點(diǎn)后反彈,深圳一位私募人士向第一財(cái)經(jīng)記者表示。雖然上證指數(shù)多年 -
 A股全線(xiàn)飄綠三大股指均收跌逾5% 滬指失守3000點(diǎn) 4月25日,A股全線(xiàn)飄綠,三大股指均收跌逾5%,其中滬指失守3000點(diǎn),最低下探至2928 51點(diǎn),系自2020年6月19日以來(lái)的指數(shù)新低。深證成指收跌6
A股全線(xiàn)飄綠三大股指均收跌逾5% 滬指失守3000點(diǎn) 4月25日,A股全線(xiàn)飄綠,三大股指均收跌逾5%,其中滬指失守3000點(diǎn),最低下探至2928 51點(diǎn),系自2020年6月19日以來(lái)的指數(shù)新低。深證成指收跌6 -
 多個(gè)奢侈品牌宣布提價(jià) 奢侈品本身不具備真正的投資價(jià)值 近期,多個(gè)奢侈品牌宣布提價(jià),奢侈品市場(chǎng)漲聲一片。在奢侈品保值增值預(yù)期下,一些消費(fèi)者受到刺激,動(dòng)起了投資的念頭。分析人士提醒,奢侈品
多個(gè)奢侈品牌宣布提價(jià) 奢侈品本身不具備真正的投資價(jià)值 近期,多個(gè)奢侈品牌宣布提價(jià),奢侈品市場(chǎng)漲聲一片。在奢侈品保值增值預(yù)期下,一些消費(fèi)者受到刺激,動(dòng)起了投資的念頭。分析人士提醒,奢侈品 -
 十幾元錢(qián)的奶茶,冰雪時(shí)光是怎么做到好喝又高級(jí)的? 隨著消費(fèi)的不斷升級(jí),近幾年新式茶飲店也如雨后春筍般的崛起,街邊隨處可見(jiàn)各種品牌的茶飲店鋪。消費(fèi)者也從最開(kāi)始的單純追求口感,到現(xiàn)在健
十幾元錢(qián)的奶茶,冰雪時(shí)光是怎么做到好喝又高級(jí)的? 隨著消費(fèi)的不斷升級(jí),近幾年新式茶飲店也如雨后春筍般的崛起,街邊隨處可見(jiàn)各種品牌的茶飲店鋪。消費(fèi)者也從最開(kāi)始的單純追求口感,到現(xiàn)在健 -
 北京豐臺(tái)全力保障居民“菜籃子” 新發(fā)地蔬菜交易市場(chǎng)有序進(jìn)行 為做好保供穩(wěn)價(jià)工作,北京市豐臺(tái)區(qū)今天啟動(dòng)點(diǎn)對(duì)點(diǎn)補(bǔ)貨機(jī)制,第一時(shí)間發(fā)動(dòng)新發(fā)地、岳各莊兩大批發(fā)市場(chǎng),做好貨源組織工作,協(xié)調(diào)加快保供車(chē)輛
北京豐臺(tái)全力保障居民“菜籃子” 新發(fā)地蔬菜交易市場(chǎng)有序進(jìn)行 為做好保供穩(wěn)價(jià)工作,北京市豐臺(tái)區(qū)今天啟動(dòng)點(diǎn)對(duì)點(diǎn)補(bǔ)貨機(jī)制,第一時(shí)間發(fā)動(dòng)新發(fā)地、岳各莊兩大批發(fā)市場(chǎng),做好貨源組織工作,協(xié)調(diào)加快保供車(chē)輛 -
 伊施以勒簽約“創(chuàng)世紀(jì)-米開(kāi)朗基羅”進(jìn)軍中國(guó)數(shù)字藏品市場(chǎng) 作為元宇宙的重要應(yīng)用方式,數(shù)字藏品市場(chǎng)短期內(nèi)在我國(guó)爆發(fā)式增長(zhǎng),成為文旅行業(yè)廣泛關(guān)注的焦點(diǎn)。作為國(guó)際頂級(jí)IP的創(chuàng)世紀(jì)-米開(kāi)朗基羅,近日
伊施以勒簽約“創(chuàng)世紀(jì)-米開(kāi)朗基羅”進(jìn)軍中國(guó)數(shù)字藏品市場(chǎng) 作為元宇宙的重要應(yīng)用方式,數(shù)字藏品市場(chǎng)短期內(nèi)在我國(guó)爆發(fā)式增長(zhǎng),成為文旅行業(yè)廣泛關(guān)注的焦點(diǎn)。作為國(guó)際頂級(jí)IP的創(chuàng)世紀(jì)-米開(kāi)朗基羅,近日 -
 “土貨”成為搶手“網(wǎng)貨” 秀山縣大力發(fā)展農(nóng)村電商產(chǎn)業(yè) 長(zhǎng)久以來(lái),物流產(chǎn)品人才是制約農(nóng)村電商發(fā)展的三大難題。重慶秀山縣以構(gòu)建城鄉(xiāng)雙向物流、打造電商產(chǎn)業(yè)扶貧基地、開(kāi)展電商培訓(xùn)等手段破解難題
“土貨”成為搶手“網(wǎng)貨” 秀山縣大力發(fā)展農(nóng)村電商產(chǎn)業(yè) 長(zhǎng)久以來(lái),物流產(chǎn)品人才是制約農(nóng)村電商發(fā)展的三大難題。重慶秀山縣以構(gòu)建城鄉(xiāng)雙向物流、打造電商產(chǎn)業(yè)扶貧基地、開(kāi)展電商培訓(xùn)等手段破解難題
熱門(mén)資訊
-
 知名數(shù)字資產(chǎn)交易平臺(tái)8V與Onramper達(dá)成合作,強(qiáng)強(qiáng)賦能OTC業(yè)務(wù) 近日,知名元宇宙生態(tài)數(shù)字資產(chǎn)交易...
知名數(shù)字資產(chǎn)交易平臺(tái)8V與Onramper達(dá)成合作,強(qiáng)強(qiáng)賦能OTC業(yè)務(wù) 近日,知名元宇宙生態(tài)數(shù)字資產(chǎn)交易... -
 外匯天眼:外匯交易中出金有問(wèn)題,如何正確維權(quán)? 關(guān)注外匯天眼的投資者一定經(jīng)常到天...
外匯天眼:外匯交易中出金有問(wèn)題,如何正確維權(quán)? 關(guān)注外匯天眼的投資者一定經(jīng)常到天... -
 健康飲食需求激增!DROODS道得富以健康食品助力改善國(guó)民健康水平 自健康中國(guó)戰(zhàn)略實(shí)施以來(lái),人民群眾...
健康飲食需求激增!DROODS道得富以健康食品助力改善國(guó)民健康水平 自健康中國(guó)戰(zhàn)略實(shí)施以來(lái),人民群眾... -
 常州京城皮膚病醫(yī)院樊戰(zhàn)軍:為什么很多皮膚病夜間覺(jué)得瘙癢 有皮膚病的友友們有沒(méi)有覺(jué)得很疑惑...
常州京城皮膚病醫(yī)院樊戰(zhàn)軍:為什么很多皮膚病夜間覺(jué)得瘙癢 有皮膚病的友友們有沒(méi)有覺(jué)得很疑惑...
觀(guān)察
- 1 “銀發(fā)經(jīng)濟(jì)”躍上風(fēng)口 養(yǎng)老產(chǎn)業(yè)...
- 2 加快發(fā)展外貿(mào)新業(yè)態(tài)新模式 支持...
- 3 加快發(fā)展外貿(mào)新業(yè)態(tài)新模式 充分...
- 4 網(wǎng)絡(luò)經(jīng)濟(jì)快速發(fā)展 網(wǎng)絡(luò)消費(fèi)糾紛...
- 5 本輪成品油調(diào)價(jià)周期內(nèi) 國(guó)際市場(chǎng)...
- 6 山東省對(duì)外貿(mào)易實(shí)現(xiàn)創(chuàng)新發(fā)展 利...
- 7 陜西內(nèi)陸開(kāi)放高地建設(shè)扎實(shí)推進(jìn) ...
- 8 RCEP正式生效2個(gè)月來(lái)紅利顯現(xiàn) ...
- 9 我國(guó)實(shí)際使用外資首次突破1萬(wàn)億...
- 10 多措并舉穩(wěn)定外貿(mào) 擴(kuò)大出口信用...
圖片新聞
-
 山東開(kāi)展藥品經(jīng)營(yíng)專(zhuān)項(xiàng)檢查 及時(shí)排查和化解風(fēng)險(xiǎn)隱患 日前,山東省藥品監(jiān)督管理局印發(fā)《...
山東開(kāi)展藥品經(jīng)營(yíng)專(zhuān)項(xiàng)檢查 及時(shí)排查和化解風(fēng)險(xiǎn)隱患 日前,山東省藥品監(jiān)督管理局印發(fā)《... -
 國(guó)家外匯管理局深化外匯領(lǐng)域改革開(kāi)放 促進(jìn)跨境貿(mào)易投資便利化 中國(guó)人民銀行、銀保監(jiān)會(huì)、證監(jiān)會(huì)、...
國(guó)家外匯管理局深化外匯領(lǐng)域改革開(kāi)放 促進(jìn)跨境貿(mào)易投資便利化 中國(guó)人民銀行、銀保監(jiān)會(huì)、證監(jiān)會(huì)、... -
 全球氣候變化問(wèn)題日益突出 零碳咖啡見(jiàn)證綠色辦會(huì) 柜臺(tái)前排起長(zhǎng)龍,咖啡師兩手并用,...
全球氣候變化問(wèn)題日益突出 零碳咖啡見(jiàn)證綠色辦會(huì) 柜臺(tái)前排起長(zhǎng)龍,咖啡師兩手并用,... -
 “酸菜味”方便面回歸超市貨架 方便面市場(chǎng)空間被擠壓 近日,多家企業(yè)的酸菜味方便面紛紛...
“酸菜味”方便面回歸超市貨架 方便面市場(chǎng)空間被擠壓 近日,多家企業(yè)的酸菜味方便面紛紛...
精彩新聞
-
 河南發(fā)放轉(zhuǎn)向資金補(bǔ)貼 升級(jí)賞花春游產(chǎn)業(yè)鏈 五一將至,春夏之交,全國(guó)許多地方...
河南發(fā)放轉(zhuǎn)向資金補(bǔ)貼 升級(jí)賞花春游產(chǎn)業(yè)鏈 五一將至,春夏之交,全國(guó)許多地方... -
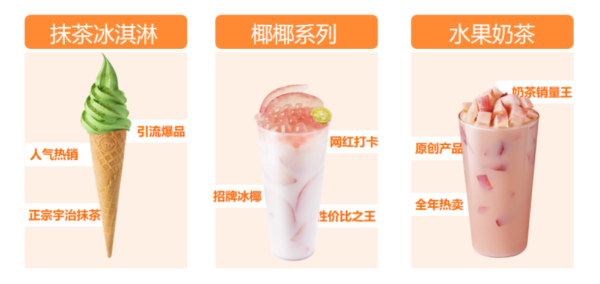 餐飲寒冬季,冰雪時(shí)光為何掀起開(kāi)店熱潮? 2020年以來(lái),疫情的陰影一直籠罩著...
餐飲寒冬季,冰雪時(shí)光為何掀起開(kāi)店熱潮? 2020年以來(lái),疫情的陰影一直籠罩著... -
 我國(guó)消費(fèi)者權(quán)益保護(hù)工作面臨挑戰(zhàn) 加大消費(fèi)者權(quán)益保護(hù)力度 中國(guó)消費(fèi)者協(xié)會(huì)近日在北京發(fā)布《中...
我國(guó)消費(fèi)者權(quán)益保護(hù)工作面臨挑戰(zhàn) 加大消費(fèi)者權(quán)益保護(hù)力度 中國(guó)消費(fèi)者協(xié)會(huì)近日在北京發(fā)布《中... -
 多家銀行在個(gè)人碳賬戶(hù)方面進(jìn)行嘗試 以零售業(yè)務(wù)作為主要突破口 個(gè)人碳積分達(dá)到一定數(shù)量,可以用于...
多家銀行在個(gè)人碳賬戶(hù)方面進(jìn)行嘗試 以零售業(yè)務(wù)作為主要突破口 個(gè)人碳積分達(dá)到一定數(shù)量,可以用于... -
 個(gè)人養(yǎng)老金制度出臺(tái) 切實(shí)保障養(yǎng)老金投資運(yùn)作安全規(guī)范 國(guó)務(wù)院辦公廳近日印發(fā)《關(guān)于推動(dòng)個(gè)...
個(gè)人養(yǎng)老金制度出臺(tái) 切實(shí)保障養(yǎng)老金投資運(yùn)作安全規(guī)范 國(guó)務(wù)院辦公廳近日印發(fā)《關(guān)于推動(dòng)個(gè)... -
 吉林省畜牧局多措并舉 加快推動(dòng)畜牧企業(yè)復(fù)工復(fù)產(chǎn) 4月25日,記者從吉林省召開(kāi)的新聞...
吉林省畜牧局多措并舉 加快推動(dòng)畜牧企業(yè)復(fù)工復(fù)產(chǎn) 4月25日,記者從吉林省召開(kāi)的新聞... -
 交通運(yùn)輸部舉行新聞發(fā)布會(huì) 保持經(jīng)濟(jì)運(yùn)行在合理區(qū)間 今天(4月26日),交通運(yùn)輸部舉行新...
交通運(yùn)輸部舉行新聞發(fā)布會(huì) 保持經(jīng)濟(jì)運(yùn)行在合理區(qū)間 今天(4月26日),交通運(yùn)輸部舉行新... -
 直擊第53屆卡思曼伯意大利博洛尼亞國(guó)際美容展!邀您云端逛展 第53屆卡思曼伯意大利博洛尼亞國(guó)際...
直擊第53屆卡思曼伯意大利博洛尼亞國(guó)際美容展!邀您云端逛展 第53屆卡思曼伯意大利博洛尼亞國(guó)際... - 盈康生命發(fā)布業(yè)績(jī)預(yù)告,實(shí)控人一致行動(dòng)人增持彰顯信心 4月25日,盈康生命科技股份有限公...
-
 學(xué)前教育資源結(jié)構(gòu)發(fā)生格局性變化 幼兒園“小學(xué)化”治理成效顯著 教育部今天舉行新聞發(fā)布會(huì),介紹黨...
學(xué)前教育資源結(jié)構(gòu)發(fā)生格局性變化 幼兒園“小學(xué)化”治理成效顯著 教育部今天舉行新聞發(fā)布會(huì),介紹黨... -
 多數(shù)省份一季度經(jīng)濟(jì)運(yùn)行平穩(wěn)開(kāi)局 江西增速領(lǐng)跑 總體來(lái)看,大多數(shù)省份一季度經(jīng)濟(jì)運(yùn)...
多數(shù)省份一季度經(jīng)濟(jì)運(yùn)行平穩(wěn)開(kāi)局 江西增速領(lǐng)跑 總體來(lái)看,大多數(shù)省份一季度經(jīng)濟(jì)運(yùn)... -
 阿卡索優(yōu)享1v1課程廣受贊譽(yù) 阿卡索作為一家在英語(yǔ)教育行業(yè)擁有...
阿卡索優(yōu)享1v1課程廣受贊譽(yù) 阿卡索作為一家在英語(yǔ)教育行業(yè)擁有... -
 世界知識(shí)產(chǎn)權(quán)日 | 天威誠(chéng)信助力專(zhuān)利證書(shū)全面電子化,激發(fā)產(chǎn)業(yè)創(chuàng)新發(fā)展活力 今天,是第22個(gè)世界知識(shí)產(chǎn)權(quán)日。世...
世界知識(shí)產(chǎn)權(quán)日 | 天威誠(chéng)信助力專(zhuān)利證書(shū)全面電子化,激發(fā)產(chǎn)業(yè)創(chuàng)新發(fā)展活力 今天,是第22個(gè)世界知識(shí)產(chǎn)權(quán)日。世... -
 健康飲食需求激增!DROODS道得富以健康食品助力改善國(guó)民健康水平 自健康中國(guó)戰(zhàn)略實(shí)施以來(lái),人民群眾...
健康飲食需求激增!DROODS道得富以健康食品助力改善國(guó)民健康水平 自健康中國(guó)戰(zhàn)略實(shí)施以來(lái),人民群眾... -
 助力疫情期間“不斷奶” 達(dá)能紐迪希亞守護(hù)上海兒童營(yíng)養(yǎng) “不掉隊(duì)” 四月以來(lái),達(dá)能紐迪希亞生命早期營(yíng)...
助力疫情期間“不斷奶” 達(dá)能紐迪希亞守護(hù)上海兒童營(yíng)養(yǎng) “不掉隊(duì)” 四月以來(lái),達(dá)能紐迪希亞生命早期營(yíng)... - 盈康生命發(fā)布2021年業(yè)績(jī)預(yù)告,預(yù)計(jì)營(yíng)收首超10億 4月25日,盈康生命科技股份有限公...
-
 草莓、荔枝、桃花……近100種新口味低度酒在天貓超市開(kāi)賣(mài) 初夏將至,口味新、包裝潮的低度酒...
草莓、荔枝、桃花……近100種新口味低度酒在天貓超市開(kāi)賣(mài) 初夏將至,口味新、包裝潮的低度酒... -
 戴口罩也能人臉識(shí)別 亞略特智能防疫設(shè)備落地醫(yī)院防疫一線(xiàn) 前不久,蘋(píng)果發(fā)布了iOS 15 4,新...
戴口罩也能人臉識(shí)別 亞略特智能防疫設(shè)備落地醫(yī)院防疫一線(xiàn) 前不久,蘋(píng)果發(fā)布了iOS 15 4,新... -
 軌道插座是智商稅嗎?安全好用的MEYEO美沿移動(dòng)軌道插座,PICK一下! 軌道插座是不是智商稅?軌道插座是...
軌道插座是智商稅嗎?安全好用的MEYEO美沿移動(dòng)軌道插座,PICK一下! 軌道插座是不是智商稅?軌道插座是... -
 電商江湖千帆競(jìng)發(fā),卷尾科技助力企業(yè)直播帶貨 短視頻應(yīng)用的興起,直播成為了當(dāng)下...
電商江湖千帆競(jìng)發(fā),卷尾科技助力企業(yè)直播帶貨 短視頻應(yīng)用的興起,直播成為了當(dāng)下... -
 菜鳥(niǎo)正展開(kāi)街道攻堅(jiān)戰(zhàn) 天貓超市上海配送逐步恢復(fù) 上海快遞物流恢復(fù)情況如何?記者從...
菜鳥(niǎo)正展開(kāi)街道攻堅(jiān)戰(zhàn) 天貓超市上海配送逐步恢復(fù) 上海快遞物流恢復(fù)情況如何?記者從... -
 Blueglass 自然探索騎行,成為更好的自己 不要忘記去體驗(yàn)偉大不要忘記去致敬...
Blueglass 自然探索騎行,成為更好的自己 不要忘記去體驗(yàn)偉大不要忘記去致敬... -
 2022年五一假期鐵路客票預(yù)售期是多長(zhǎng)時(shí)間 自2022年4月7日起,鐵路客票預(yù)售期...
2022年五一假期鐵路客票預(yù)售期是多長(zhǎng)時(shí)間 自2022年4月7日起,鐵路客票預(yù)售期... -
 5月1日起取消初中畢業(yè)后普職分流 讓更多人可以升入普通高中 新修訂的《中華人民共和國(guó)職業(yè)教育...
5月1日起取消初中畢業(yè)后普職分流 讓更多人可以升入普通高中 新修訂的《中華人民共和國(guó)職業(yè)教育... -
 2022年廣州從化區(qū)幼兒園招生 電腦搖號(hào)的比例為招生學(xué)位數(shù)的90% 非小區(qū)配套幼兒園:從化區(qū)幼兒園、...
2022年廣州從化區(qū)幼兒園招生 電腦搖號(hào)的比例為招生學(xué)位數(shù)的90% 非小區(qū)配套幼兒園:從化區(qū)幼兒園、... -
 常州京城皮膚病醫(yī)院樊戰(zhàn)軍:為什么很多皮膚病夜間覺(jué)得瘙癢 有皮膚病的友友們有沒(méi)有覺(jué)得很疑惑...
常州京城皮膚病醫(yī)院樊戰(zhàn)軍:為什么很多皮膚病夜間覺(jué)得瘙癢 有皮膚病的友友們有沒(méi)有覺(jué)得很疑惑... -
 廣州地鐵8號(hào)線(xiàn)同德站B、C口恢復(fù)通行 A口位于管控區(qū)繼續(xù)關(guān)閉 圖源:廣州交通微博結(jié)合白云區(qū)疫情...
廣州地鐵8號(hào)線(xiàn)同德站B、C口恢復(fù)通行 A口位于管控區(qū)繼續(xù)關(guān)閉 圖源:廣州交通微博結(jié)合白云區(qū)疫情... -
 4月25日廣州白云區(qū)公交站點(diǎn)線(xiàn)路情況一覽 結(jié)合白云區(qū)疫情防控的部分三區(qū)調(diào)整...
4月25日廣州白云區(qū)公交站點(diǎn)線(xiàn)路情況一覽 結(jié)合白云區(qū)疫情防控的部分三區(qū)調(diào)整... -
 新技術(shù)“膨體聚四氟乙烯淚溝矯正”在《中國(guó)美容醫(yī)學(xué)》成功發(fā)表 《中國(guó)美容醫(yī)學(xué)》4月2日消息,中日...
新技術(shù)“膨體聚四氟乙烯淚溝矯正”在《中國(guó)美容醫(yī)學(xué)》成功發(fā)表 《中國(guó)美容醫(yī)學(xué)》4月2日消息,中日... -
 “膨體聚四氟乙烯淚溝矯正”在《中國(guó)美容醫(yī)學(xué)》成功發(fā)表 近日,由中日友好醫(yī)院整形外科副主...
“膨體聚四氟乙烯淚溝矯正”在《中國(guó)美容醫(yī)學(xué)》成功發(fā)表 近日,由中日友好醫(yī)院整形外科副主... -
 動(dòng)起來(lái)!與FITURE魔鏡見(jiàn)習(xí)教練楊舒予一起變身甜酷女孩 近日,國(guó)內(nèi)知名健身鏡品牌FITURE魔...
動(dòng)起來(lái)!與FITURE魔鏡見(jiàn)習(xí)教練楊舒予一起變身甜酷女孩 近日,國(guó)內(nèi)知名健身鏡品牌FITURE魔... -
 “書(shū)”送甜蜜力量 蜜雪點(diǎn)亮希望 蜜雪冰城總動(dòng)員為鄉(xiāng)村孩子們捐贈(zèng)圖書(shū) 2022年4月23日是第27個(gè)世界讀書(shū)日...
“書(shū)”送甜蜜力量 蜜雪點(diǎn)亮希望 蜜雪冰城總動(dòng)員為鄉(xiāng)村孩子們捐贈(zèng)圖書(shū) 2022年4月23日是第27個(gè)世界讀書(shū)日... -
 吉林加強(qiáng)蓄水工程管理 確保春灌供水安全 4月24日,記者從本輪吉林省疫情防...
吉林加強(qiáng)蓄水工程管理 確保春灌供水安全 4月24日,記者從本輪吉林省疫情防... -
 山東開(kāi)展藥品經(jīng)營(yíng)專(zhuān)項(xiàng)檢查 及時(shí)排查和化解風(fēng)險(xiǎn)隱患 日前,山東省藥品監(jiān)督管理局印發(fā)《...
山東開(kāi)展藥品經(jīng)營(yíng)專(zhuān)項(xiàng)檢查 及時(shí)排查和化解風(fēng)險(xiǎn)隱患 日前,山東省藥品監(jiān)督管理局印發(fā)《... -
 國(guó)家外匯管理局深化外匯領(lǐng)域改革開(kāi)放 促進(jìn)跨境貿(mào)易投資便利化 中國(guó)人民銀行、銀保監(jiān)會(huì)、證監(jiān)會(huì)、...
國(guó)家外匯管理局深化外匯領(lǐng)域改革開(kāi)放 促進(jìn)跨境貿(mào)易投資便利化 中國(guó)人民銀行、銀保監(jiān)會(huì)、證監(jiān)會(huì)、... -
 全球氣候變化問(wèn)題日益突出 零碳咖啡見(jiàn)證綠色辦會(huì) 柜臺(tái)前排起長(zhǎng)龍,咖啡師兩手并用,...
全球氣候變化問(wèn)題日益突出 零碳咖啡見(jiàn)證綠色辦會(huì) 柜臺(tái)前排起長(zhǎng)龍,咖啡師兩手并用,... -
 “酸菜味”方便面回歸超市貨架 方便面市場(chǎng)空間被擠壓 近日,多家企業(yè)的酸菜味方便面紛紛...
“酸菜味”方便面回歸超市貨架 方便面市場(chǎng)空間被擠壓 近日,多家企業(yè)的酸菜味方便面紛紛... -
 人民銀行將普惠小微企業(yè)貸款延期支持工具轉(zhuǎn)換為支持工具 記者從人民銀行廣州分行獲悉,近日...
人民銀行將普惠小微企業(yè)貸款延期支持工具轉(zhuǎn)換為支持工具 記者從人民銀行廣州分行獲悉,近日... -
 北京商超通過(guò)產(chǎn)地直采調(diào)貨機(jī)制緊急增加貨量 保障市場(chǎng)供應(yīng)穩(wěn)定 面對(duì)突發(fā)的疫情,北京各大商超企業(yè)...
北京商超通過(guò)產(chǎn)地直采調(diào)貨機(jī)制緊急增加貨量 保障市場(chǎng)供應(yīng)穩(wěn)定 面對(duì)突發(fā)的疫情,北京各大商超企業(yè)... -
 農(nóng)村“一刻鐘”建模 一體化縣域商業(yè)網(wǎng)絡(luò)體系升級(jí) 北京的便民商業(yè)網(wǎng)點(diǎn)建設(shè)已從市區(qū)延...
農(nóng)村“一刻鐘”建模 一體化縣域商業(yè)網(wǎng)絡(luò)體系升級(jí) 北京的便民商業(yè)網(wǎng)點(diǎn)建設(shè)已從市區(qū)延... -
 百萬(wàn)醫(yī)療險(xiǎn)0免賠額產(chǎn)品面世 緩解小額醫(yī)療費(fèi)用無(wú)法理賠痛點(diǎn) 幾百元的保費(fèi)、上百萬(wàn)元的保額,百...
百萬(wàn)醫(yī)療險(xiǎn)0免賠額產(chǎn)品面世 緩解小額醫(yī)療費(fèi)用無(wú)法理賠痛點(diǎn) 幾百元的保費(fèi)、上百萬(wàn)元的保額,百... -
 步步高披露2021年業(yè)績(jī)預(yù)告 凈利潤(rùn)同比由盈轉(zhuǎn)虧 4月25日,步步高(002251)一字跌停...
步步高披露2021年業(yè)績(jī)預(yù)告 凈利潤(rùn)同比由盈轉(zhuǎn)虧 4月25日,步步高(002251)一字跌停... -
 資金掮客卷土重來(lái) 做起了“過(guò)橋”融資的生意 受疫情多地散發(fā)影響,部分用戶(hù)因確...
資金掮客卷土重來(lái) 做起了“過(guò)橋”融資的生意 受疫情多地散發(fā)影響,部分用戶(hù)因確... -
 辛巴再陷“假貨”風(fēng)波 到底誰(shuí)才是“正品”? 主播辛巴再陷假貨風(fēng)波,辛巴與涉事...
辛巴再陷“假貨”風(fēng)波 到底誰(shuí)才是“正品”? 主播辛巴再陷假貨風(fēng)波,辛巴與涉事... -
 自動(dòng)駕駛是場(chǎng)馬拉松 資本明顯往頭部企業(yè)聚集 這塊碳是我和團(tuán)隊(duì)調(diào)研礦山時(shí)撿回來(lái)...
自動(dòng)駕駛是場(chǎng)馬拉松 資本明顯往頭部企業(yè)聚集 這塊碳是我和團(tuán)隊(duì)調(diào)研礦山時(shí)撿回來(lái)... -
 濰坊高新區(qū)通過(guò)工業(yè)地產(chǎn)模式建設(shè)動(dòng)力裝備國(guó)際配套產(chǎn)業(yè)園 產(chǎn)業(yè)是城市發(fā)展的基石,優(yōu)化其生態(tài)...
濰坊高新區(qū)通過(guò)工業(yè)地產(chǎn)模式建設(shè)動(dòng)力裝備國(guó)際配套產(chǎn)業(yè)園 產(chǎn)業(yè)是城市發(fā)展的基石,優(yōu)化其生態(tài)... -
 國(guó)內(nèi)咖啡豆市場(chǎng)持續(xù)火爆 保稅倉(cāng)儲(chǔ)業(yè)務(wù)減少關(guān)稅成本等資金占用 日前,在辦結(jié)海關(guān)監(jiān)管通關(guān)手續(xù)后,...
國(guó)內(nèi)咖啡豆市場(chǎng)持續(xù)火爆 保稅倉(cāng)儲(chǔ)業(yè)務(wù)減少關(guān)稅成本等資金占用 日前,在辦結(jié)海關(guān)監(jiān)管通關(guān)手續(xù)后,... -
 遼寧省持續(xù)優(yōu)化口岸營(yíng)商環(huán)境 為市場(chǎng)主體提供通關(guān)預(yù)期 2022年以來(lái),遼寧省堅(jiān)決貫徹黨中央...
遼寧省持續(xù)優(yōu)化口岸營(yíng)商環(huán)境 為市場(chǎng)主體提供通關(guān)預(yù)期 2022年以來(lái),遼寧省堅(jiān)決貫徹黨中央... -
 我國(guó)冷鏈物流行業(yè)高質(zhì)量發(fā)展 布局建設(shè)骨干冷鏈物流基地 近日,交通運(yùn)輸部、國(guó)家鐵路局、中...
我國(guó)冷鏈物流行業(yè)高質(zhì)量發(fā)展 布局建設(shè)骨干冷鏈物流基地 近日,交通運(yùn)輸部、國(guó)家鐵路局、中... -
 江蘇省依托廣交會(huì)產(chǎn)業(yè)幫扶優(yōu)勢(shì) 幫助特色產(chǎn)業(yè)對(duì)接大市場(chǎng) 走過(guò)六十五載的中國(guó)第一展,除了作...
江蘇省依托廣交會(huì)產(chǎn)業(yè)幫扶優(yōu)勢(shì) 幫助特色產(chǎn)業(yè)對(duì)接大市場(chǎng) 走過(guò)六十五載的中國(guó)第一展,除了作...